Nyt molekyle lukker ned for vigtigt anti-kræftgen
Vores celler besidder en sikkerhedsafbryder som registrerer når mutationer omdanner normale gener til kræftgener og når der er risiko for at der udvikles kræft. Denne celleældningsmekanisme kaldes senescens og forhindrer cellerne i at dele sig. Ny grundforskning fra BRIC, Københavns Universitet, afslører et hidtil ukendt molekyle, MIR31HG, som regulerer én af de vigtigste aktører i denne sikkerhedsmekanisme, nemlig p16INK4a. Resultaterne publiceres i Nature Communications.
Ny forskning viser, at en stor mængde nye molekyler kan udnyttes til at forstå og bekæmpe kræft.
- MIR31HG tilhører en nyligt funden gruppe molekyler kaldet lange ikke-kodende RNA. Disse molekyler findes i stort antal af vores celler, men vi ved meget lidt om deres funktion og betydning når det gælder sygdomme, siger postdoc Marta Montes som var drivkraften bag projektet.
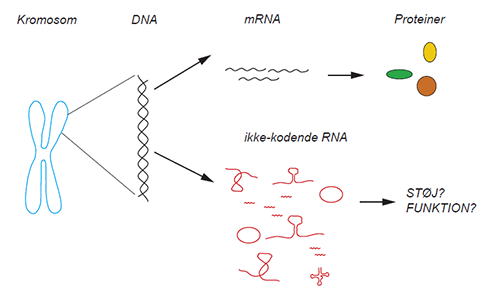
I den menneskelige arvemasse findes de oplysninger der kræves for at producere alle de proteiner, et menneske kræver for korrekt udvikling og funktion. Denne information er kodet af DNA'et. For at producere proteiner, skal dele af DNA’et først kopieres ind i RNA-molekyler som derefter danner skabeloner til fremstilling af proteiner. Takket være de nyeste teknikker, er det blevet bevist, at der også er yderligere information til stede i DNA, som ikke resulterer i produktion af proteiner - kun RNA. Denne "ikke-kodende" del repræsenterer en forbløffende 80 % af den menneskelige arvemasse, og at lange ikke-kodende RNA er fremstillet af denne ikke-kodende del af vores arvemasse.
- I mange år mente forskere, at disse lange ikke-kodende RNA måtte være støj med ringe betydning for vores udvikling eller sundhed. Men nu viser det sig, at mange af disse molekyler rent faktisk spiller nøgleroller i vigtige cellulære processer samt i kræft, siger professor Anders H Lund som leder forskningsgruppen på BRIC hvor forskningen fandt sted.
I normale celler binder MIR31HG kontrolboksen af anti-kræftgenet p16INK4a sammen med Polycomb repressor proteinerne for at forhindre p16INK4a produktionen. Når kræftgener muteres eller aktiveres er MIR31HG og Polycomb proteinerne ikke længere til stede på p16INK4a, hvilket tillader p16INK4a produktion og dermed en cellecyklusstandsning. Med denne mekanisme, kaldet onkogen-induceret senescens, forhindres forstadier til kræft i at udvikle sig. Illustration: Marta Montes.
MIR31HG undertrykker ekspressionen af anti-kræftgenet p16INKA
Med avancerede teknikker har forskerne på BRIC målt, hvilke af de ikke-kodende RNA der er vigtige for celleældning, og her fandt de, at MIR31HG er vigtig for reguleringen af det kendte anti-kræftgen og cellecyklusregulator, p16INK4a.
- Vi har vist, at MIR31HG binder til p16INK4a genet og letter bindingen af en gruppe af proteiner kaldet Polycomb proteiner. Disse proteiner kan lukke ned for p16INK4a produktionen og derved forhindre p16INK4a’s evne til at stoppe celledelingen. Hvis vi derimod fjerner MIR31HG fra cellerne, starter de på celleældningsprocessen og stopper med at dele sig fordi p16INK4a nu kan udtrykkes, forklarer Marta Montes.
Niveauerne af p16INK4a proteinet forøges i celler som har behov for at stoppe med at dele sig, fx når de fornemmer en kræfttrussel. Et rigtigt godt eksempel er modermærkekræft. Før kræften udvikler sig til ondartet, registrerer hudcellerne et aktiveret kræftgen BRAF og øger niveauet af p16INK4a, og hudcellerne ældes og stopper med at dele sig. Andre mutationer, der kan forekomme senere, kan tillade cellen at undslippe denne ældningsbarriere og udvikle sig til ondartet modermærkekræft.
- Ved at øge vores viden om hvordan disse anti-kræftgener reguleres, håber vi at bane vejen for nye terapeutiske metoder i behandlingen af kræft, afslutter Marta Montes.
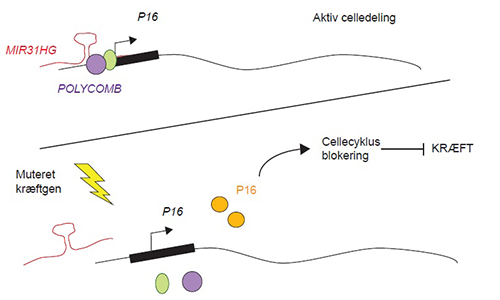
I normale celler binder MIR31HG kontrolboksen af anti-kræftgenet p16INK4a sammen med Polycomb repressor proteinerne for at forhindre p16INK4a produktionen. Når kræftgener muteres eller aktiveres er MIR31HG og Polycomb proteinerne ikke længere til stede på p16INK4a, hvilket tillader p16INK4a produktion og dermed en cellecyklusstandsning. Med denne mekanisme, kaldet onkogen-induceret senescens, forhindres forstadier til kræft i at udvikle sig. Illustration: Marta Montes.
Forskningen er støttet af Marie Curie, IEF bevilling, og Kræftens Bekæmpelse.
Kontakt
Professor Anders H. Lund, BRIC
Telefon: 3532 5657
E-mail: anders.lund@bric.ku.dk
Postdoc Marta Montes, BRIC
Telefon: 3533 5039
E-mail: marta.montes@bric.ku.dk
Original artikel
The lncRNA MIR31HG regulates p16INK4A expression to modulate senescence. M. Montes, M.M. Nielsen, G. Maglieri, A. Jacobsen, J. Højfeldt, S. Agrawal-Singh, K. Hansen, K. Helin, H.J.G. van de Werken, J.S. Pedersen and A.H. Lund. Nature Communications. April 2015.
